

Clonatest
250 résultats
-
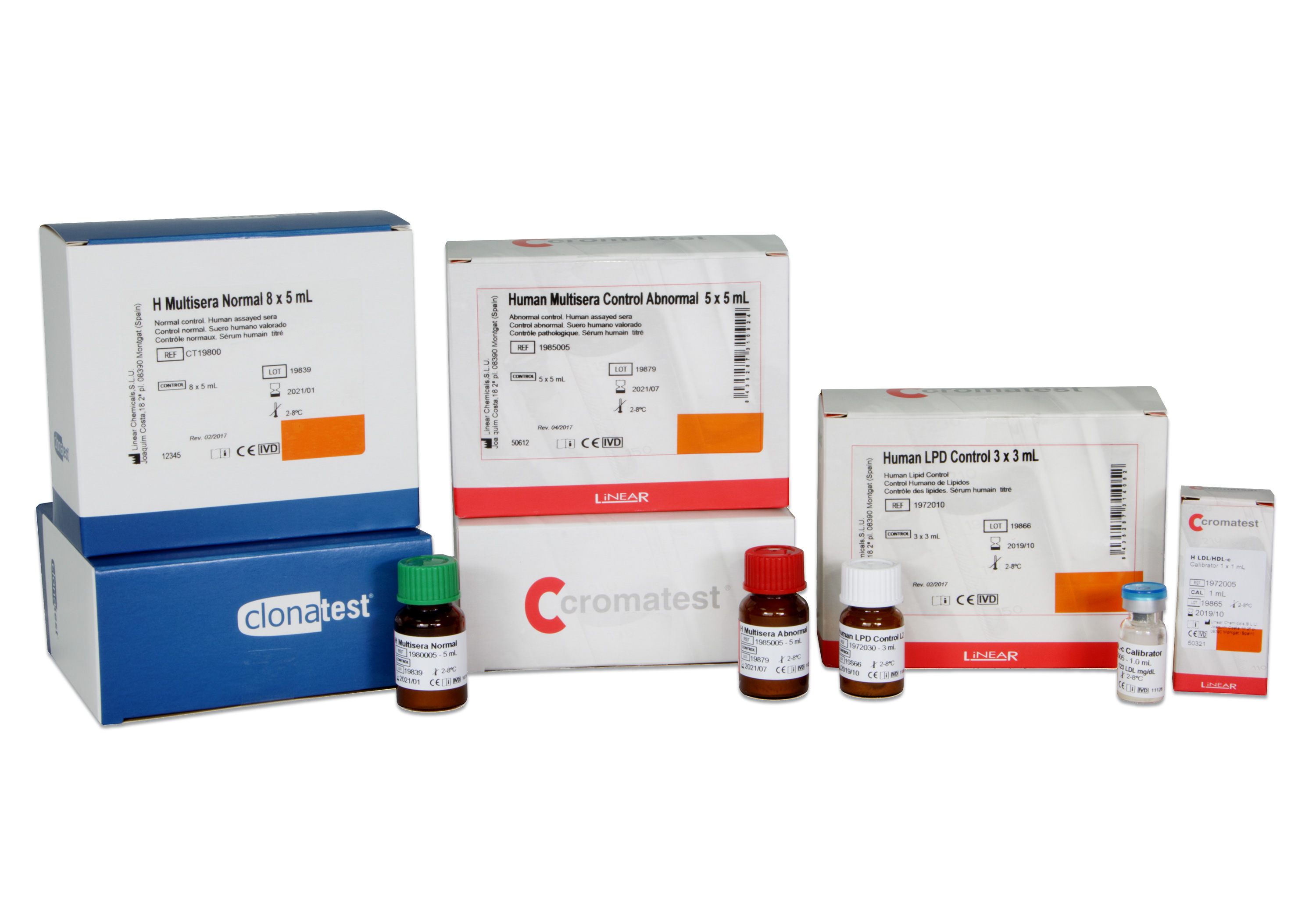
-

-

Multisera Humana Normal 5x5 ml
1980005LINEAR Human Multisera Normal es un suero estabilizado y liofilizado de origen humano. Este control está elaborado a partir de sangre de donantes voluntarios de diferentes Bancos de Sangre. Los datos analíticos del Human Multisera Normal se han elaborado en colaboración entre laboratorios de reconocido prestigio, utilizando métodos de referencia.
-

Ácido Úrico MR 6x40 ml
CT10392El ácido úrico es oxidado por la acción de la uricasa, en alantoina y peróxido de hidrógeno. En presencia de peroxidasa (POD) la mezcla de diclorofenol sulfonato (DCBS) y 4-aminoantipirina (4-AA) se condensan por acción del peróxido de hidrógeno, formando una quinonaimina coloreada proporcional a la concentración de ácido úrico en la muestra.
-

Urea/BUN BR 12x50 ml
CT10385La urea es hidrolizada por la ureasa descomponiéndola en amoníaco y dióxido de carbono. El amoníaco por acción de la glutamato deshidrogenasa (GlDH) se convierte en glutamato en presencia de NADH y cetoglutarato. La reacción se mide cinéticamente a 340 nm a través de la disminución de la absorbancia resultante de la oxidación del NADH a NAD+, proporcional a la concentración de urea presente en la muestra.
-

Ácido Úrico MR 2x50 ml
1161005El ácido úrico es oxidado por la acción de la uricasa, en alantoina y peróxido de hidrógeno. En presencia de peroxidasa (POD) la mezcla de diclorofenol sulfonato (DCBS) y 4-aminoantipirina (4-AA) se condensan por acción del peróxido de hidrógeno, formando una quinonaimina coloreada proporcional a la concentración de ácido úrico en la muestra.
-

Ácido Úrico MR 10x60 ml
CT10395El ácido úrico es oxidado por la acción de la uricasa, en alantoina y peróxido de hidrógeno. En presencia de peroxidasa (POD) la mezcla de diclorofenol sulfonato (DCBS) y 4-aminoantipirina (4-AA) se condensan por acción del peróxido de hidrógeno, formando una quinonaimina coloreada proporcional a la concentración de ácido úrico en la muestra.
-

-

Albúmina Estándar 5 g/dL 1x3 ml
1901005 -

Proteína Total 6x40 ml
CT10352En la reacción del biuret se forma un quelato entre el ión Cu2+ y los enlaces peptídicos de las proteínas en medio alcalino con la formación de un complejo coloreado violeta cuya absorbancia se mide fotométricamente. La intensidad del color producido es proporcional a la concentración de proteínas en la muestra.
-

Triglicéridos MR 2x50 ml
1155005El método está basado en la hidrólisis enzimática de los triglicéridos séricos a glicerol y ácidos grasos libres (FFA) por acción de la lipoprotein lipasa (LPL). El glicerol es fosforilado por el adenosin trifosfato (ATP) en presencia de glicerolquinasa (GK) para formar glicerol-3-fosfato (G-3-P) y adenosin difosfato (ADP). El G-3-P es oxidado por la glicerofosfato oxidasa (GPO) en dihidroxiacetona fosfato (DHAP) y peróxido de hidrógeno. En presencia de peroxidasa (POD) el fenol y la 4-aminoantipirina (4-AA) se condensan por acción del peróxido de hidrógeno (H2O2) formándose un cromógeno rojo proporcional a la concentración de triglicéridos presentes en la muestra.
-

Proteína Total 10x60 ml
CT10355En la reacción del biuret se forma un quelato entre el ión Cu2+ y los enlaces peptídicos de las proteínas en medio alcalino con la formación de un complejo coloreado violeta cuya absorbancia se mide fotométricamente. La intensidad del color producido es proporcional a la concentración de proteínas en la muestra.